Pozdní ototoxicita cisplatiny u pacientů s meduloblastomem
Late Ototoxicity of Cisplatin in Patients with Medulloblastoma
Cisplatin is presently a widely used chemotherapeutic in many types of neoplasms. It causes various side effects, though. The literature indicates sensoric-neural hearing disorder as one of the side effects affecting more than 26% to 90% of patients according to the type of tumor, therapy and patient’s condition. The follow up of hearing is important not only during chemotherapy, when the change of therapeutic plan may prevent significant hearing loss, but also afterwards for late effects of cisplatin use.
Key words:
cisplatin, sensoric-neural hearing disorder, medulloblastoma, late consequences.
Autoři:
D. Hošnová 1; T. Kepák 2; M. Brož 2
Působiště autorů:
Klinika dětské ORL LF MU a FN Brno
1; Klinika dětské onkologie LF MU a FN Brno
2
Vyšlo v časopise:
Otorinolaryngol Foniatr, 61, 2012, No. 1, pp. 23-28.
Kategorie:
Původní práce
Souhrn
Cisplatina je v současné době široce užívaným chemoterapeutikem u mnoha typů neoplazií. Má však celou řadu nežádoucích účinků. Literatura uvádí, že senzorineurální porucha sluchu, jako jeden z nežádoucích účinků, postihuje od 26 % do více než 90 % pacientů, dle typu tumoru, typu terapie, stavu pacienta. Sledování stavu sluchu je důležité nejen v průběhu chemoterapie, kdy eventuální změna léčebného plánu může zamezit výraznější poruše sluchu, ale i po ukončení chemoterapie pro pozdní následky užívání cisplatiny.
Klíčová slova:
cisplatina, senzorineurální porucha sluchu, meduloblastom, pozdní následky.
ÚVOD
Meduloblastom představuje nejčastější maligní nádor centrálního nervového systému dětského věku. Tvoří přibližně 15-20 % všech primárních nádorů CNS a až 40 % tumorů zadní lební jámy ve věkové skupině 0-19 let. S mírnou převahou se častěji vyskytuje u chlapců. Incidence je 0,2-0,6/100 000 dětí. Ročně onemocní v ČR 10-12 dětí. Medián věku v době diagnózy je 9 let. Meduloblastom nejčastěji vyrůstá z vermis mozečku a obyčejně při svém růstu uzavře 4. mozkovou komoru za vzniku obstrukčního hydrocefalu. Velmi záhy metastazuje. Leptomeningeální metastázy jsou často zjištěny již v době diagnózy. Klinicky se meduloblastom projevuje mozečkovými příznaky (ataxie, porucha koordinace pohybů) a syndromem intrakraniální hypertenze (bolest hlavy, zvracení, poruchy zraku, parézy hlavových nervů). Plně vyjádřený syndrom intrakraniální hypertenze je u dětí spíše pozdním následkem, v kojeneckém věku se projevuje dráždivostí, potížemi s krmením, neprospíváním, zvracením.
Diagnostika se opírá v kojeneckém věku o UZ vyšetření intrakraniálních struktur přes neuzavřenou velkou fontanelu. Počítačová tomografie s intarvenózním kontrastem a magnetická rezonance jsou rozhodujícími vyšetřovacími metodami při diagnostice meduloblastomu. Rozsah nemoci při diagnóze je většinou hodnocen dle Changovy klasifikace nádorů zadní lební jámy. Standardem při vyšetřování je oční a neurologické vyšetření, rovněž endokrinologické, foniatrické a psychologické.
Pacienti s meduloblastomy jsou řazeni do prognosticky odlišných skupin, a to pacienti s meduloblastomem středního a pacienti s meduloblastomem vysokého rizika. Podle tohoto rozdělení se pak přistupuje k terapii. U pacientů s meduloblastomem středního rizika je primární neurochirurgický zákrok, následovaný adjuvantní radioterapií (redukované ozáření kraniospinální osy 23,4 Gy a boost na zadní lební jámu do celkové dávky 54,0–55,8 Gy). A dále pak podávání adjuvantní chemoterapie (kombinace alkylancia a derivátu platiny), např. protokol CCGA 9961.
U meduloblastomu vysokého rizika je rovněž první léčebnou metodou primární resekce tumoru, následována adjuvantní radioterapií 36 Gy s boostem na ZJL do dávky 55,8 Gy zpravidla s konkomitantní readiosenzitizující chemoterapií, a poté adjuvantní chemoterapie s režimy alkylancií a platiny – např. SJMB 96–4 cykly submyeloablativní CHT (6). V léčbě meduloblastomu hrají tedy platinové deriváty důležitou roli.
Cisplatina jako účinné chemoterapeutikum byla objevena v r. 1972. Je indikována u celé řady neoplazií. Její užití je však limitováno celou řadou nežádoucích účinků: nefrotoxicita, myelotoxicita, postižení GIT, periferní neuropatie, a v neposlední řadě ototoxicita.
Ztráta sluchu u pacientů léčených cisplatinou je velmi variabilní. Závisí na mnoha faktorech - dávce cisplatiny , počtu cyklů chemoterapie, způsobu podání, současném užívání dalších látek s ototoxickým účinkem (aminoglykosidy, salicyláty, kličková diuretika, ostatní deriváty platiny, erytromycin, Vankomycin), dále závisí na věku pacienta, jeho nutričním stavu (nízká hladina sérových proteinů, anemie, váha…). Současně probíhající radioterapie na oblast hlavy, již preexistující onemocnění vnitřního ucha, tumorózní postižení samotné sluchové dráhy, hluk, a rovněž genetické faktory.
Symptomy ototoxicity zahrnují subjektivní ztrátu sluchu, tinitus, někdy otalgii, vertigo. Ztráta sluchu je charakterizována senzorineurální poruchou sluchu, postihující typicky vysoké frekvence, a s dalším užíváním cisplatiny progredující do nižších frekvencí. V iniciálních stadiích je ztráta sluchu reverzibilní, později se stává ireverzibilní. Je oboustranně symetrická. Cisplatina na buněčné úrovní způsobuje destrukci zevních vláskových buněk a tato destrukce postupuje směrem od báze k apexu. V literatuře se uvádí signifikantně nižší hladina antioxidačních mechanismů v zevních vláskových buňkách při bázi hlemýždě ve srovnání s apexem (5).
Cisplatina rovněž destruuje vnitřní vláskové buňky, podpůrné buňky Cortiho orgánu, buňky spirálního ganglia, atrofii stria vaskularis, kolaps Reisnerovy membrány. Destrukce probíhá ve všech případech na podkladě apoptózy po vyčerpání antioxidačních mechanismů buněk (1, 2, 3).
Jak již bylo zmíněno, je audiologické a foniatrické vyšetření jedním ze standardních vyšetření doporučené jednotlivými léčebnými protokoly. Každý pacient podstupuje baterii vyšetření počínaje odebráním osobní i rodinné anamnézy, zaměřujeme se na sluchové postižení v rodině, onemocnění uší u pacienta, prodělané operace. Následuje otoskopické vyšetření, zhodnocení stavu středouší pomocí tympanometrie a stanovení středoušních reflexů.
Prahový tónový audiogram je u spolupracujících pacientů zlatým standardem. U pacientů léčených cisplatinou mívá audiometrická křivka charakteristický tvar s predilekčním postižením vysokých frekvencí a bývá stranově symetrická. Ke zjištění iniciálního postižení sluchu se dnes s výhodou užívá vysokofrekvenční audiometrie (UHF), jež měří sluchový práh při frekvencích 12,16 kHz. Tyto frekvence bývají u pacientů léčených cisplatinou postiženy nejdříve (4). U malých a/nebo nespolupracujích dětí používáme k vyšetření sluchu vyšetření otoakustických emisí (TEOAE), odrážející činnost zevních vláskových buněk, které jsou k působení cisplatiny ze všech struktur kochley nejsenzitivnější. Nevýbavnost OAE tedy může znamenat subklinické kochleární poškození. Nevýhodou je jejich frekvenční nespecifičnost. Distorzní produkt otoakustických emisí DPOAE je naproti tomu frekvenčně specifický, umožňuje změřit odhadovaný audiogram, čehož je s výhodou užíváno u malých dětí. Pro delší časovou náročnost tohoto vyšetření nejsou na našem pracovišti měřeny ambulantně, ale většinou za hospitalizace na KDO. Těchto metod (TEOAE, DPOAE) je však možnou užít pouze pokud není patologie ve středouší.
V neposlední řadě se při stanovení sluchového prahu opíráme o vyšetření kmenových evokovaných potenciálů (BAEP), především u malých a nespolupracujících dětí a u pacientů s patologií středouší. O eventuální indikaci sluchadel pomáhá rozhodovat dětský percepční test a slovní audiometrie dle věku pacienta. Sluch pacientů je ohodnocen stupňovacím systémem dle Brock. Tento systém byl vyvinut speciálně pro charakteristiku poruch sluchu, které jsou způsobené cisplatinou.
METODIKA
Na pracovišti KDORL LF MU a FN Brno byli pacienti vyšetřeni s ohledem na věk, fyzický stav a mentalitu pomocí prahové tónové audiometrie, UHF, audiometrie hrou, vyšetření kmenových potenciálů BAEP, vyšetření DPOAE s odhadem audiogramu. Všichni byli vyšetřeni na počátku CHT, většinou již po operaci a na konci chemoterapie. Částečně retrospektivně, částečně prospektivně byly hodnoceny audiogramy pacientů vždy po 1 roce od ukončení chemoterapie. V souboru je několik pacientů sledovaných až 7 let, tito však do studie nejsou zařazeni pro jejich malý počet.
VÝSLEDKY
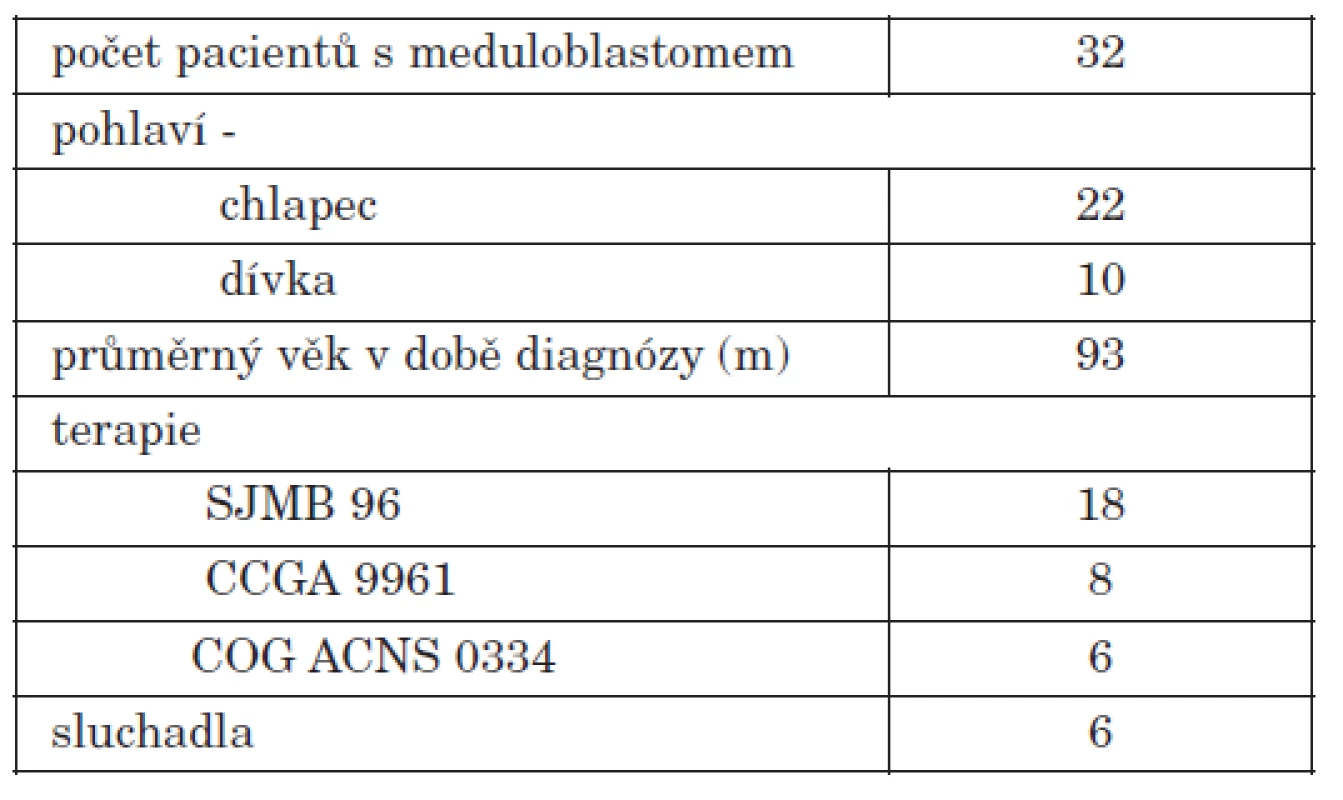
Na foniatrické ambulanci a ve spolupráci s KDO bylo vyšetřeno celkem 32 pacientů s dg meduloblastom zadní lební jámy – 22 chlapců a 10 dívek. 18 pacientů bylo léčeno protokolem SJMB 96, 8 pacientů CCG A9961, 6 pacientů protokolem COG ACNS 0034 (tab. 1).
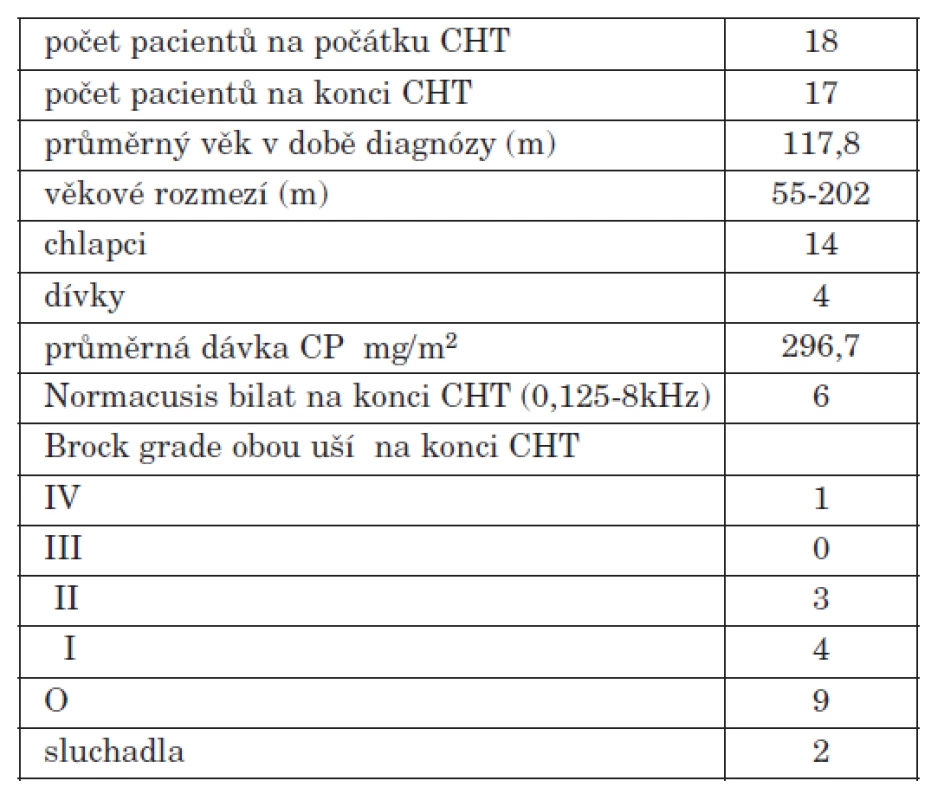
Skupina pacientů léčených protokolem SJMB 96 zahrnuje 18 dětí, 14 chlapců a 4 dívky. Jeden pacient nebyl zařazen pro neúplnost audiometrických dat. Všichni pacienti podstoupili primární neurochirurgcký výkon, radioterapii a 4 cykly submyeloablativní chemoterapie, zahrnující mimo jiné cisplatinu. Kumulativní dávka CP byla v průměru 296,7 mg/m2.
Na počátku chemoterapie měli všichni pacienti normacusi, na konci chemoterapie mělo normacusi bilat. (0,125-8 kHz) celkem 6 pacientů, z nichž u 4 byla pomocí vysokofrekvenční audiometrie (12,16 kHz) diagnostikována počínající percepční nedoslýchavost. Zbylých 11 pacientů mělo pokles sluchu určitého stupně (tab. 2). Z původních 18 pacientů byla vytvořena podskupina pacientů, u nichž byl sluch měřen pravidelně po 1 roce po dobu 3 let (tab. 3). Ostatní pacienti měli kratší sledovací dobu z důvodu úmrtí, nebo jsou sledováni jiným pracovištěm. Průměrné audiogramy pacientů vždy po roce od ukončení chemoterapie jsou vyobrazeny na grafech 1 a 2. Zhodnocení dle Brock na grafech 3 a 4.
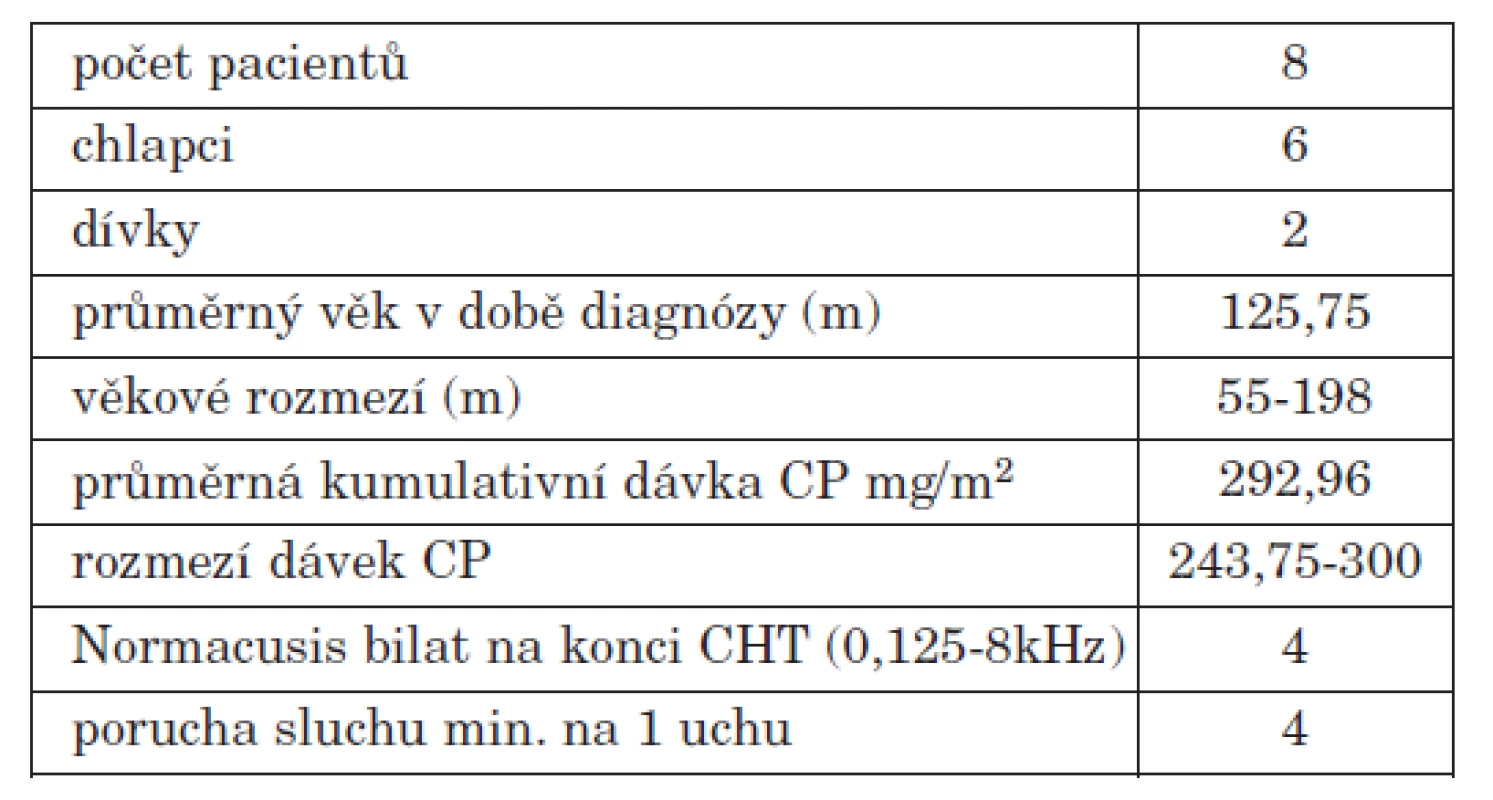




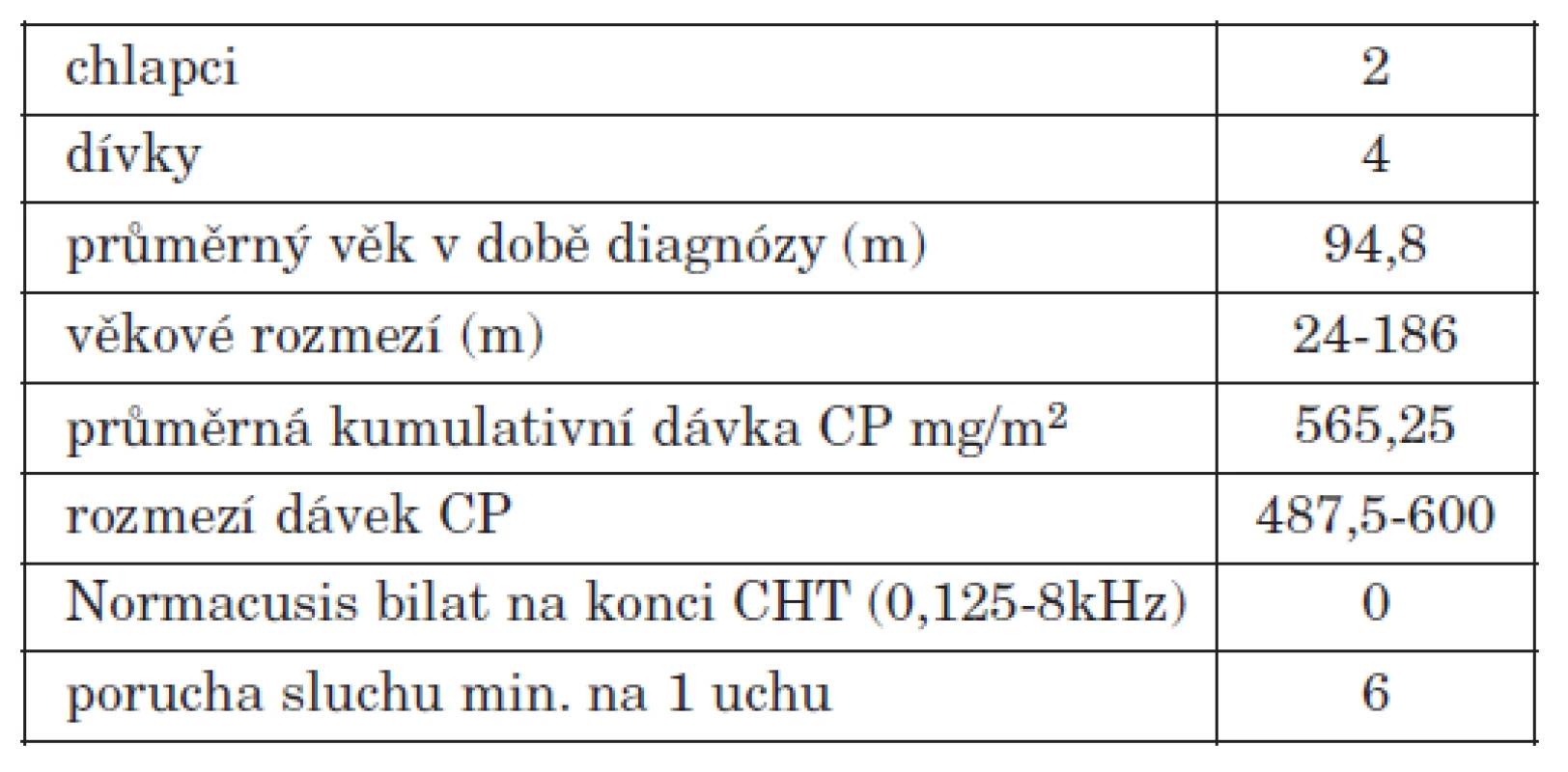
Jak je z audiogramů i grafů patrné, nedochází u této skupiny k výraznějšímu zhoršování sluchu s odstupem let od ukončení chemoterapie. Pacienti léčeni protokolem CCG A9961 jsou pacienti standardního rizika, mají redukovanou dávku radioterapie, ale vyšší dávku cisplatiny, průměrná kumulativní dávka CP u pacientů v našem souboru je 565,25mg/m2. V této skupině je zařazeno celkem 8 pacientů, všichni měli na začátku CHT normacusi, na konci (měřeno 0,125-8 kHz) měli všichni poruchu sluchu určitého stupně ( Brock 0-3) (tab. 4). Stejně jako u pacientů léčených protokolem SJMB 96 byla vytvořena podskupina pacientů sledovaných více let (zde jen 2 roky od ukončení chemoterapie) (tab. 5). Pacienti léčení protokolem CCGA 9961 podléhají vyššímu riziku postižení sluchu nejen na konci CHT, ale sluch se jim výrazně horší i několik let po léčbě.
Pacientů, kteří podstoupili terapii dle protokolu COG ACNS 0334, bylo pouze pět. Pro jejich věk (v průměru 17m.) bylo k vyšetření sluchu užito měření DPOAE s odhadem audiogramu a vyšetření BAEP. Dle tohoto protokolu dostávají pacienti dávku cisplatiny 10,5 mg/kg váhy. Tato skupina je uváděna pouze pro úplnost (kvůli malému počtu pacientů, neúplnosti audiometrických dat). Na počátku CHT měli všichni pacienti normacusi, na konci CHT poruchu sluchu minimálně Brock 2.
DISKUSE
Cisplatina má řadu nežádoucích účinků. Některé účinky je možno ovlivnit účinnou prevencí, u některých, jako je např. ototoxicita, je užití těchto prostředků pouze ve fázi laboratorního zkoumání (transtympanální aplikace kortikoidů) (1), nebo mají nejisté výsledky. Pokud dojde k výraznější poruše sluchu již během chemoterapie, dávka cisplatiny se redukuje, eventuálně se mění za méně toxický preparát. Je samozřejmé, že eventuální postižení sluchu i trvalého charakteru nevyrovná profit získaný antitumorozním účinkem cisplatiny, nicméně pravidelné sledování sluchu a včasné upozornění onkologa je nanejvýše vhodné, zvláště pak u malých dětí z důvodu rozvoje řeči a dalšího zařazení do sociálního života.
Audiologické sledování pacientů léčených cisplatinou je v současné době ve většině případů nahodilé, u dospělých pacientů prakticky žádné, neklade se důraz na pravidelné, intervalové měření sluchu, zvláště u velmi malých dětí, především z důvodu jejich nespolupráce a rovněž v nedokonalém systému popisu jednotlivých stupňů poruchy sluchu.
Předložená studie má řadu úskalí a limitací. Sluch u pacientů s meduloblastomem může být rovněž poškozen celou řadou jiných nox a situací, které ve studii nejsou zařazeny. Jedná se např. o užití aminoglykosidů, užití dalších chemoterapeutik s ototoxickým účinkem, dávku radioterapie, druh operace, celkový stav a spolupráci pacienta. Rovněž výběr audiometrických metod.
ZÁVĚR
Z uvedeného přehledu jasně plyne důležitost vyšetřování sluchu pacientů, kteří podstupují terapii obsahující cisplatinu, a to i po ukončení chemoterapie, i když onkologické standardy tuto skutečnost neuvádějí. Zvláště v dětském věku je vhodné zvát pacienty na pravidelné kontroly sluchu i po ukončení léčby, samo dítě mnohdy zhoršení sluchu ani nepocítí, nebo na něj záměrně neupozorní, aby se vyhnulo eventuálnímu užívání sluchadlové protetiky. Můžeme jen doufat, že nebude trvat dlouho a do praxe budou zavedeny i preventivní prostředky zabraňující poruše sluchu, nebo alespoň zmírňující její tíži.
MUDr. Dagmar Hošnová
KDORL FN Brno
Černopolní 9
625 00 Brno
e-mail: dagmarp@email.cz
Zdroje
1. Gerhard, W. H., Kent, M., Kourosh, P.:Cisplatin-induced ototoxicity: Effect of intratympanic dexamethasone injections. Otol Neurotol., 2008.
2. Kolinsky, D. C., Hayashi, S. S., Karzon, R., Mao, J., Hayashi, R. J.: Late onset hearing loss: A signific and complication of cancer survivors treated with cisplatin containing chemotherapy regimens. Journal of Pediatric Hematology/Oncology, 2010.
3. Kristin, R., Dale, F. K., Edward, A.: Ototoxicity in children receiving platinum chemotherapy: Underestimating a commonly occurring toxicity that may influence academic and social development. Journal of Clinical Oncology, 2005.
4. Kristin, R. K., Dale, F. K.: Early changes in auditory function as a result of platinum chemotherapy: Use of extended high-frequency audiometry and evoked distortion product otoacoustic emissions. Journal of Clinical Oncology, 2007.
5. Sha, S. H., Taylor, R., Forge, A., Schacht, J.: Differential vulnerability of basal and apical hair cells is based on intrinsic susceptibility to free radicals, 2001.
6. Zitterbart, K., Pavelka, Z., Zitterbartová, J.: Meduloblastom: Nejčastější zhoubný nádor mozku u dětí. Onkologie, 2010.
Štítky
Audiologie a foniatrie Dětská otorinolaryngologie OtorinolaryngologieČlánek vyšel v časopise
Otorinolaryngologie a foniatrie

2012 Číslo 1
-
Všechny články tohoto čísla
- Hodnocení reedukace hlasu po operaci benigních útvarů hlasivek
- Pozdní ototoxicita cisplatiny u pacientů s meduloblastomem
- Krvácení po tonzilektomii a tonzilotomii u dětí
- Konvenční versus miniinvazivní video-asistovaná tyroidektomie: Limity a benefity miniinvazivního přístupu
- Translabyrintná kraniotómia pre odstránenie vestibulárneho schwanómu
- Porovnání pěveckých technik sólového a sborového zpěvu
- Prínos PET/CT vyšetrenia do diagnostiky neznámeho primárneho tumoru s metastázovaním do krčných lymfatických uzlín - naše skúsenosti
- Nezvyčajná prezentácia Non- Hodgkinovho lymfómu v ORL oblasti
- Faryngitida způsobená Streptococcus pyogenes
- 51. otologický den k 85. narozeninám prof. MUDr. Lubomíra Faltýnka, DrSc.
- Kurz „Endoskopická chirurgie hypofýzy a lební baze“
- Postlaryngectomy Rehabilitation Workshop
- Preparační kurz ORL s mezinárodní účastí – chirurgie nosu a vedlejších nosních dutin
- CENA ZA NEJLEPŠÍ PUBLIKACI
- Co na „suchý“ nos?
- Otorinolaryngologie a foniatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Co na „suchý“ nos?
- Faryngitida způsobená Streptococcus pyogenes
- Krvácení po tonzilektomii a tonzilotomii u dětí
- Translabyrintná kraniotómia pre odstránenie vestibulárneho schwanómu