Přítomnost Helicobacter pylori v orofaryngu a její vztah k žaludeční infekci
Oropharyngeal Presence of Helicobacter Pylori and Its Relation to Stomach Infection
Helicobacter pylori (HP) is one of the most important human pathogens. This bacterium is associated with chronic gastritis, gastric ulcers and gastric adenocarcinoma and MALT lymphoma. HP was detected in the oral cavity in saliva and dental plaque recently. By this time the stomach was considered to be the only reservoir of this bacterium in humans. The main aim of this work was to prove that the presence of HP in oropharynx could be independent of stomach infection. Twenty individuals with previously proven oropharyngeal presence of HP were investigated for gastric infection using Urea Breath Test (UBT).
Only 8 individuals showed gastric infection. Twelve patients (63.12%) were UBT negative. These data show that HP can be present in the oropharyngeal area independently to the gastric infection..
Key words:
Helicobacter pylori, Urea Breath test, oropharynx, PCR, stomach.
Autoři:
E. Nártová 1; P. Lukeš 1; E. Pavlík 2; I. Šterzl 2; J. Astl 1; J. Betka 1
Působiště autorů:
Klinika ORL a chirurgie hlavy a krku 1. LF UK a FN Motol, Praha
Katedra otorinolaryngologie IPVZ, Praha
; přednosta prof. MUDr. J. Betka, DrSc.
Ústav imunologie a mikrobiologie 1. LF UK a VFN, Praha
1; přednosta prof. MUDr. I. Šterzl, CSc.
2
Vyšlo v časopise:
Otorinolaryngol Foniatr, 58, 2009, No. 2, pp. 97-101.
Kategorie:
Původní práce
Souhrn
Helicobacter pylori (HP) je významný lidský patogen, který je spojován s chronickou gastritidou, žaludečním vředem a s nádory žaludku, především s adenokarcinomem a MALT lymfomem. V posledních letech byl HP nalezen v ústní dutině, především ve slinách a dentálním plaku. Do této doby byl za jediný rezervoár infekce HP v lidském organismu považován žaludek. Cílem práce bylo zjištění, zda může být HP v orofaryngu přítomen nezávisle na žaludeční infekci. Do studie bylo zařazeno 20 osob s prokázanou přítomností HP v orofaryngu. U těchto osob byla zjišťována žaludeční infekce ureázovým dechovým testem (UBT). Přítomnost HP v žaludku byla prokázána pouze u 8 jedinců. Zbylých 12 pacientů bylo UBT negativních. Z těchto výsledků vyplývá, že HP může být přítomen v orofaryngeální oblasti nezávisle na žaludeční infekci.
Klíčová slova:
Helicobacter pylori (HP), ureázový dechový test (UBT), orofaryng, PCR, žaludek.
ÚVOD
Infekce HP je rozšířena po celém světě. Ve státech střední a východní Evropy je promořenost udávána od 60 do 95 % (4). V rozvojových zemích je vysoké procento infekce spojeno s nízkým so-cioekonomickým statutem a infekce se zpravidla rozvíjí od časného dětství. Naopak ve vyspělých zemích je prevalence nízká. Klinické projevy se objevují pouze u 10-15 % nakažených jedinců, což je dáno různou imunitní odpovědí hostitele a odlišným stupněm virulence kmenů (24).
Nejvýznamnějšími faktory virulence jsou vakuolizační cytotoxin (vac A) a cytotoxin asociovaný gen (CagA), dále adheziny, lipopolysacharid a ureáza (20). VacA je cytotoxin, který indukuje vakuolizaci epiteliálních buněk. Je kódován genem vac A, který nesou všechny kmeny HP. Pouze asi 50 % kmenů produkuje vac A protein (22). Kmeny produkující toxin jsou spojovány s vyšším výskytem peptických vředů a rakoviny žaludku. Mezi jednotlivými kmeny existují ve struktuře vacA genu rozdíly. Za velmi toxické jsou považovány kmeny s alelami s1 m1 a jsou spojovány s mnoha formami gastritidy, atrofie a intestinální metaplázie [10]. Přítomnost vacA také indukuje expresi VEGF (vascular endothelial growth factor) a vede ke spuštění nádorového procesu (20).
CagA gen, čili cytotoxin - asociovaný gen A - kóduje vysokomolekulární a vysoce imunoreaktivní protein, který je přítomný asi u 60 % kmenů HP (20). Tento gen je součástí ostrůvku patogenicity cag - PAI, který zahrnuje 31 genů , které hrají roli v aktivaci chemokinů a MAP - kinázy v cestě aktivace prozánětlivých faktorů (20). V hostitelské buňce je cag A fosforylován kinázami ze skupiny Src, což vede k produkci různých cytokinů a růstových faktorů (22). Kmeny s přítomností cagA jsou označovány jako CagA+. Pacienti infikovaní těmito kmeny mají vyšší zánětlivou odpověď a je u nich zaznamenán vyšší výskyt peptických vředů, atrofické gastritidy, rakoviny žaludku (15). Protein cagA a další virulentní faktory jsou do hostitelské buňky injektovány prostřednictvím sekrečního systému typu IV (10).
Přežití HP je možné díky schopnosti produkovat ureázu, což je enzym, který štěpí v žaludku ureu na amoniak a oxid uhličitý. Zajišťuje neutralizaci kyselého prostředí ve svém okolí. Ureáza hraje důležitou roli ve vyhodnocení ureázového dechového testu. Při stanovení pozitivity/negativity UBT se laboratorně vyhodnocuje koncentrace oxidu značeného uhličitého ve vydechovaném vzduchu.
Infekce HP aktivuje neutrofily, které tvoří volné radikály (ROS), zejména superoxid a hydrogen peroxidový ion. Proti těmto radikálům existují v buňkách žaludeční sliznice enzymy, které ROS ničí. Vysoká aktivita těchto enzymů byla zaznamenána u Cag A+ kmenů HP (20).
Po proniknutí HP do žaludku se uplatňuje imunita přirozená a imunita získaná. Přirozenou imunitu zastupují antigen prezentující buňky, a to zvláště buňky dendritické a monocyty. Tyto buňky mají na svém povrchu TLRs (Toll - like receptors). Po kontaktu s bakterií dochází k sekreci prozánětlivých cytokinů – TNF-α, IL - 1β a IL - 8 (22). IL - 8 má vliv na buněčnou proliferaci, migraci a tumorovou angiogenezi. Dominantní odpovědí je Th - 1 imunitní odpověď v žaludeční sliznici, charakterizovaná indukcí IFN - γ. Th - 1 odpověď je spojená se zvýšeným vyplavováním prozánětlivých cytokinů – IL - 12, IL - 18 a TNF - α a vede k produkci IgG (22).
METODY PRŮKAZU HP
Metody průkazu HP jsou invazivní a neinvazivní. Pro žaludek se jako standardní test používá ureázový dechový test – Urea Breath Test (UBT).
UBT je v současné době považován za zlatý standard metod k detekci Helicobacter pylori v žaludku (14). První vztah UBT (14C) k detekci žaludeční ureázové aktivity u kočky byl publikován v roce 1954 Kornbergem. V roce 1987 byl použit Grahamem neradioaktivní izotop uhlíku 13 C, což je prvek v prostředí přirozeně přítomný. Vzorky jsou analyzovány metodou hmotnostní spektrometrie, nebo metodou NDIRS (nondispersive infrared spectrometry). Tato metoda je založená na změnách oscilačního spektra molekul izotopů CO2 v infračerveném světle. Použití této metody spočívá měření absolutních koncentrací plynu a naměřené hodnoty více kolísají. Důležité je kritérium změny poměru vydechovaného CO2 v čase 30 oproti T - DOB větší než 5 š (14). Dechový test byl použit i v modifikovaném provedení jako endoskopický UBT, vykazující přesnost v detekci. UBT patří do popředí všech diagnostických metod HP. Podle Maastrichtského konsenzu 2 z roku 2000 se jedná o vyšetření vhodné k průkazu infekce a rovněž je pokládáno za vyšetření určené ke kontrole eradikace. Ke zhodnocení UBT byla publikována řada prací, jejichž autoři v naprosté většině považují uvedenou metodu za jednu z nejdůležitějších pro detekci HP. Největším problémem dechových testů zůstává kvantitativní interpretace. Objem vzduchu při dýchání se liší v závislosti na fyzické aktivitě, psychickém stresu a dalších faktorech. Výsledkem je jejich vysoká biologická variabilita.
VÝSKYT HP V ÚSTNÍ DUTINĚ A HLTANU
Výskyt HP v ústní dutině a hltanu je intenzivně studován. Byla prokázána jeho přítomnost v lidském dentálním plaku a ve slinách (8, 12). Důležitost tonzilární tkáně pro kolonizaci HP jako první zdůraznil Minocha (19). HP byl prokázán pomocí CLO testu v adenoidní tkáni (25). Vzorek adenoidní tkáně i patrových tonzil byl pozitivní také při použití RUT a histologie (1). Cirak a spol. (6) a Bulut a spol. (3) detekovali pomocí metody PCR Cag A+ kmeny. Bitar a spol. (2) sledovali výskyt HP v středoušním sekretu a v adenoidní vegetaci pomocí kultivace, RUT a PCR. Pozitivita HP byla zjištěna pouze ve vzorku adenoidní vegetace metodou RUT. HP byl zjištěn také ve středoušním sekretu a adenoidních vegetacích pomocí PCR s použitím primeru pro 23 S ribosomální RNA (26).Yilmaz a spol. (27)našli HP také v aspirátech středoušního sekretu pomocí kultivace a PCR. Byl také srovnáván výskyt HP na povrchu a uvnitř tonzil. Z celkem 106 vzorků bylo pozitivních 56 povrchových (53 %) a 24 vzorků ze stromatu tonzil (23 %) (13). Předpokládá se také souvislost infekce HP a orofaryngeálních nádorů. Tento vztah zkoumala řada autorů. Pouze jedna studie je však založená na genotypizaci kmenů HP pomocí metody real-time PCR (21).
Cílem práce je zjištění incidence probíhající žaludeční infekce HP pomocí ureázového dechového testu u pacientů, u kterých byla zjištěna přítomnost HP v tonzilární tkáni metodou real-time PCR.
METODY
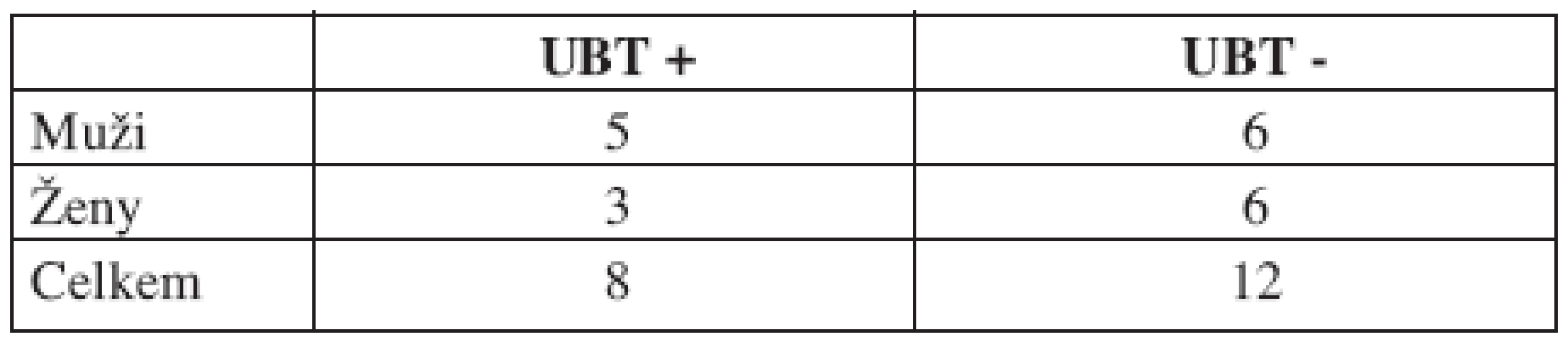
Do studie bylo zařazeno celkem 40 pacientů s diagnózou karcinomu tonzil, syndromem spánkové apnoe a chronickou tonzilitidou. Tito pacienti podstoupili v letech 2006–2008 chirurgický výkon na klinice ORL a chirurgie hlavy a krku 1. LF UK a FN v Motole. Během operace jim byl odebrán vzorek orofaryngeální tkáně. Z uvedených vzorků byla u 20 pacientů zjištěna pomocí metody real–time PCR pozitivita Helicobacter pylori v orofaryngu (tab. 1). U těchto pacientů byl proveden UBT v době od ledna do srpna 2008. U žádného z pacientů nebyla před provedením UBT provedena eradikace HP. U osob UBT pozitivních byla následně provedena gastroskopie k ověření probíhající žaludeční infekce pomocí PCR ze vzorků žaludeční sliznice.

Ureázový dechový test – Urea – Breath - Test (UBT)
Test byl prováděn ráno nalačno. Pacienti provedli výdech do prvního sáčku, poté vypili 200 ml 100% pomerančové šťávy se 100 mg 13C močoviny. Po 30 minutách byl odebrán vzorek dechu do druhého sáčku. Sáčky byly odeslány do laboratoře a zpracovány do 1 týdne od odběru.
Real–time–PCR
Real–time PCR je vysoce senzitivní variantou PCR metody. Umožňuje provádět genotypizaci jednotlivých kmenů HP přímo z tkáňových vzorků. Vyšetření byla prováděna na přístroji Light-CyclerR 2.0 s využitím specifických primerů a sond pro cagA gen a pro signální a střední sekvenci vacA genu.
VÝSLEDKY
Z dvaceti pacientů s PCR prokázanou orofaryngeální přítomností infekce HP bylo celkem 8 (40 %) UBT pozitivních. U všech těchto osob byla následně ověřena přítomnost žaludeční infekce pomocí PCR. U zbylých 12 osob (60 %) byl ureázový dechový test negativní (tab. 2, graf 1).

DISKUSE
Dosud publikované práce, jejichž cílem byla detekce HP v ústní dutině, byly většinou zaměřeny na pacienty se žaludečními obtížemi, případně s již prokázanou žaludeční infekcí HP. Pacienti zařazeni do této studie byli vybráni na základě pozitivního nálezu HP v orofaryngu a následně u nich byla zjišťována přítomnost HP v žaludku pomocí UBT. Ve shodě s prací Burgerse (5) bylo prokázáno, že se HP může nacházet v ústní dutině, aniž by byl přítomen zároveň v žaludku.
UBT je v současné době považován za zcela spolehlivou neinvazivní metodu detekce žaludeční HP infekce (7). Základní metodika UBT je uzpůsobena tak, že vylučuje detekci HP v jiné lokalizaci než v žaludku. Jedna studie byla zaměřena na aplikaci UBT v ústní dutině (16), kdy autoři nechali pacienty vyplachovat ústa roztokem značené urey.
U pacientů v této studii byla UBT pozitivita potvrzena endoskopií a detekcí HP v bioptickém materiálu. V minulosti byla diskutována otázka, zda přítomnost HP v orofaryngu není jen přechodná, např. způsobená gastroezofageálním refluxem. Výsledky této studie ukazují, že kolonizace orofaryngu je nezávislá na žaludeční infekci HP (tab. 3).

Metody detekce HP jsou invazivní a neinvazivní. Pro oblast orofaryngu jsou vhodné metody invazivní. Detekce HP v této oblasti je však značně limitována. Při použití histologie se setkáváme s problémem, který je představován výskytem jiných bakteriálních kmenů. Tato metoda je tedy málo specifická [9].
S falešně pozitivními výsledky se můžeme setkat při aplikaci CLO testu nebo RUT. Tyto metody jsou založeny na průkazu HP na základě barevné reakce, která vzniká po reakci substrátu s ureou. Hlavním důvodem možných falešně pozitivních výsledků je existence dalších ureázu-produktujících kmenů v této oblasti (9).
Kultivace je považována za zlatý standard pro detekci HP v žaludku. V ústní dutině je však její použití značně limitováno (9). Je náročná na přesnost provedení. Klinická významnost spočívá ve stanovení citlivosti vypěstovaného kmene na antibiotika, zejména v případech neúspěšné eradikace. Vzorky se vyhodnocují po týdenní inkubaci (18). Nevýhodou použití kultivace v orofaryngu je možná inhibice HP jinými orálními druhy baktérií (11).
Využití molekulárních metod (PCR) umožňuje amplifikaci HP – specifického regionu DNA (23). Využívá se standardní (end-point) PCR pro detekci zejména cagA a vacA genů (18). Tato metoda je vysoce specifická a senzitivní. Při jejím použití v orofaryngu však byly výsledky studií vysoce variabilní, mezi 0 % - 90 % (9).
Genotypizace pomocí PCR metody umožňuje rozlišovat různé kmeny HP a jejich geny kódující různé faktory virulence (21). V posledních letech je využívána také real–time PCR. Představuje zlom v diagnostice HP, protože umožňuje provádět genotypizaci jednotlivých kmenů HP přímo ze tkáňových vzorků. Při použití PCR detekce však nelze získat přesnou představu, zda se jedná o viabilní či mrtvé bakterie (9). PCR je v současné době považována za nejvíce senzitivní metodu k detekci HP v orofaryngu. Je rezistentní vůči externím faktorům a je zatížena nejmenším rizikem falešně pozitivních či falešně negativních výsledků (17).
ZÁVĚR
Na základě výsledků studie můžeme konstatovat, že infekce Helicobacter pylori může existovat samostatně v orofaryngu bez současné koexistence infekce žaludeční. Toto tvrzení dokazuje skutečnost, že většina pacientů, u nichž byla zjištěna PCR pozitivita v orofaryngu, byla UBT negativní.
MUDr. Eva Nártová
Klinika ORL a chirurgie hlavy a krku 1. LF UK a FNM
V Úvalu 84
150 06 Praha 5-Motol
Zdroje
1. Bitar, A., Soweid A. et al.: Is Helicobacter really present in the adenoids of children? Eur Arch. Otorhinolaryngol, 262, 2005, s. 987-992.
2. Bitar, M., Mahfouz, R., Soweid, A. et al.: Does Helicobacter pylori colonize the nasopharynx of children and contribute to their middle ear disease? Acta Otolaryngol, 126, 2006, s. 154-159.
3. Bulut, Y., Agacayak, A., Karlidag, T. et al. Association of Cag A+ Helicobacter pylori with adenotonsillar hypertrophy. Tohoku J. Exp. Med., 209, 2006, 3, s. 229-233.
4. Bureš, J., Kopáčová, M., Koupil, I. a kol.: Epidemiology of Helicobacter pylori infection in the Czech Republic. Helicobacter, 11, 2006, s. 56-65.
5. Bürgers, R., Schneider-Brachert, W., Reischl, U., Behr, A., Hiller, K. A., Lehn, N., Schmalz, G., Ruhl, S.: Helicobacter pylori in human oral cavity and stomach. Eur J. Oral Sci., 2008; 116, s. 297-304.
6. Cirak, M. Y., Ozdek, A., Yilmaz, D. et al.: Detection of Helicobacter pylori and its CagA gene in tonsil and adenoid tissues by PCR. Arch. Otolaryngol Head Neck Surg., 129, 2003, s. 1225-1229.
7. Cutler, A. F., Havstad, S. et al.: Accuracy of invasive and noninvasive tests to diagnose Helicobacter pylori infection. Gastroenterology, 109, 1995, 1, s. 136-141.
8. Czesnikiewicz-Guzik, M., Bielanski, W., Guzik, T. J., Loster, B., Konturek, S. J.: Helicobacter pylori in the oral cavity and its implications in gastric infection, periodontal health, immunology and dyspepsia. J. Physiol. Pharmacol., 56, 2005, Suppl. 6, s. 77-89.
9. Dowsett, S. A., Kowolik, M. J.: Oral Helicobacter pylori: Can we stomach it? Crit. Rev. Oral Biol. Med., 14, 2003, 3, s. 226-233.
10. Höcker, M., Hohenberger, P.: Helicobacter pylori virulence factors-one part of a big picture. Lancet, 362, 2003, 2 (9391), s. 1231-1233.
11. Ishihara, K., Miura, T., Kimizuka, R., Ebihara, Y., Mizuno, Y., Okuda, K.: Oral bacteria inhibit Helicobacter pylori growth. FEMS Microbiol. Lett., 152, 1997, s. 355-361.
12. Karczewska, E., Konturek, J. E., Konturek, P. C. et al.: Oral cavity as a potential source of gastric reinfection by Helicobacter pylori. Dig. Dis. Sci., 47, 2002, s. 978-986.
13. Khademi, B., Niknejad, N., Gandomi, B., Yeganeh, F.: Comparison of Helicobacter pylori colonization on the tonsillar surface versus tonsillar core tissue as determined by the CLO test. Ear Nose Throat, 86, 2007, 8, s. 498-501.
14. Kocna, P.: Dechové testy - moderní, neinvazivní diagnostika. Interní Med., 2006, 7 a 8, s. 336-341.
15. Kusters, J. G., van Vliet, A. H., Kuipers, E. J.: Pathogenesis of Helicobacter pylori infection. Clin. Microbiol. Rev., 19, 2006, 3, s. 449-490.
16. Loster, B. W., Majewski, S. W., Czesnikiewicz-Suzik, M., Bielanski, W., Pierzchalski, P., Konturek, S. J.: The relationship between the presence of Helicobacter pylori in the oral cavity and gastric in the stomach. J. Physiol. Pharmacol., 57, 2006, s. 91-100.
17. Lukeš, P., Astl, J., Pavlík, E., Potužníková, B., Šterzl, I., Betka, J.: Helicobacter pylori in tonsillar and adenoid tissue and its possible role in oropharyngeal carcinogenesis. Folia Microbiol., 54, 2008, s. .33-39.
18. Mégraud, F., Lehours, P.: Helicobacter pylori detection and antimicrobial susceptibility testing. Clin. Microbiol. Rev., 20, 2007, 2, s. 280-332.
19. Minocha, A., Raczkowski, C. A., Richards, R. J. Is a history of tonsillectomy associated with a decreased risk of Helicobacter pylori infection? J. Clin. Gastroenterol., 25, 1997, s. 580-582.
20. Olivares, D., Gisbert, J. P. et al. Factors involved in the pathogenesis of Helicobacter pylori infection. Rev. Esp. Enferm. Dig., 98, 2006, 5, s. 374-386.
21. Pavlík, E., Lukeš, P., Potužníková, B., Astl, J., Hrdá, P., Souček, A., Matucha, P., Doseděl, J., Šterzl, I.: Helicobacter pylori isolated from patients with tonsillar cancer or tonsillitis chronica could be of different genotype compared to isolates from gastrointestinal tract. Folia Microbiol., 52, 2007, s. 91-94.
22. Portal-Celhay, C., Perez-Perez, G.: Immune responses to Helicobacter pylori colonization: Mechanisms and clinical outcomes. Clin. Sci., 110, 2006, 3, s. 305-314.
23. Song, Q., Haller, B., Schmid, R. M., Adler, G., Bode, G.: Helicobacter pylori in dental plaque: a comparison of different PCR primer sets. Dig. Dis. Sci., 44, 1999, s. 479-484.
24. Stromberg, E., Edebo, A., Svennerholm, A. M., Lindholm, C. Decreased epithelial cytokine responses in the duodenal mucosa of Helicobacter pylori-infected duodenal ulcer patients. Clin. Dian. Lab. Immunol., 10, 2003, s. 116-124.
25. Unver, S., Kubilay, U., Sezen, O. S., Coskuner, T.: Investigation of Helicobacter pylori colonization in adenotonsillectomy specimens by means of CLO-test. Laryngoskope, 111, 2001, s. 2183-2186.
26. Yilmaz, M., Kara, C. O., Kaleli, I., Demir, M., Tumkaya, F., Buke, A. S., Topuz, B.: Are tonsils a reservoir for Helicobacter pylori infection in children? Int. J. Pediatr. Otorhinolaryngol, 68, 2004, s. 307-310.
27. Yilmaz, T., Ceylan, M., Akyon, Y., Ozcakyr, O., Gursel, B.: Helicobacter pylori: a possible association with otitis media with effusion. Otolaryngol Head Neck Surg., 134, 2006, s. 772-777.
Štítky
Audiologie a foniatrie Dětská otorinolaryngologie OtorinolaryngologieČlánek vyšel v časopise
Otorinolaryngologie a foniatrie

2009 Číslo 2
-
Všechny články tohoto čísla
- Přítomnost Helicobacter pylori v lymfatické tkáni nosohltanu a jeho možná souvislost se vznikem adenoidních vegetací
- Primární (vřetenobuněčný) rhabdomyosarkom podčelistní slinné žlázy (Kazuistika a přehled literatury)
- IMPLANTÁT HYBRID - NOVÁ ŠANCE PRO LIDI SE ZBYTKY SLUCHU (Zpráva z tiskové konference)
- Cholesteatóm v okcipito-temporálnej oblasti
- Periferní paréza lícního nervu při středoušní manifestaci Wegenerovy granulomatózy
- Seminář „Onemocnění štítné žlázy a slinných žláz, diagnostika, léčba a komplikace“
- Recenze
- Cizí tělesa v ORL oblasti u dětí
- Parafaryngeální a retrofaryngeální absces u dětí
- Radiofrekvenčně indukovaná termoterapie tonzil u dětí
- Prognostický a prediktivní význam exprese EGFR, Her2/neu a genetických alterací v EGFR signální cestě u spinocelulárních karcinomů hlavy a krku
- Přítomnost Helicobacter pylori v orofaryngu a její vztah k žaludeční infekci
- Otorinolaryngologie a foniatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Parafaryngeální a retrofaryngeální absces u dětí
- Cizí tělesa v ORL oblasti u dětí
- Radiofrekvenčně indukovaná termoterapie tonzil u dětí
- Přítomnost Helicobacter pylori v lymfatické tkáni nosohltanu a jeho možná souvislost se vznikem adenoidních vegetací
